癌癥作為一種細(xì)胞異常增殖的疾病
是全球主要的公共衛(wèi)生問題
近日,北大杜鵬課題組揭示
植物免疫蛋白通過挽救miRNA缺陷
實(shí)現(xiàn)廣譜抗腫瘤反應(yīng)
這一發(fā)現(xiàn)為人類戰(zhàn)勝癌癥
提供了強(qiáng)大武器
一、誘發(fā)癌癥的罪魁禍?zhǔn)?/strong>
癌癥的誘因非常復(fù)雜,是胞內(nèi)多種調(diào)控通路的突變和微環(huán)境共同作用的結(jié)果,其中微小RNA(miRNA)是近年來被認(rèn)為與癌癥發(fā)生息息相關(guān)的重要RNA分子。在哺乳動(dòng)物中,具有2-nt 3'末端懸垂的成熟miRNA雙鏈可以被Argonaute(AGO)識(shí)別并裝載形成RNA誘導(dǎo)的沉默復(fù)合體(RISC)進(jìn)而調(diào)控靶基因的表達(dá)。在癌癥中,全局miRNA劑量減少被認(rèn)為是癌癥發(fā)生的誘因之一。然而,迄今為止對(duì)于不同癌癥中普遍miRNA缺乏的原因尚未被系統(tǒng)陳述。
細(xì)胞周期的過度激活是癌細(xì)胞異常增殖的必要條件,因此細(xì)胞周期基因是抗癌藥物研發(fā)的重要靶點(diǎn)。現(xiàn)有細(xì)胞周期的藥物往往只能針對(duì)一種或者幾種靶點(diǎn),因而無法克服基因冗余性而帶來的耐藥性。有意思的是,許多miRNA都可以直接靶向并抑制細(xì)胞周期基因,從而直接控制細(xì)胞增殖。因此,能否通過修復(fù)腫瘤中有缺陷的miRNA通路從而實(shí)現(xiàn)對(duì)于腫瘤細(xì)胞增殖的抑制,就一直是一個(gè)懸而未決的生物學(xué)問題。一旦成功,則可開發(fā)成為一種腫瘤治療的新策略。
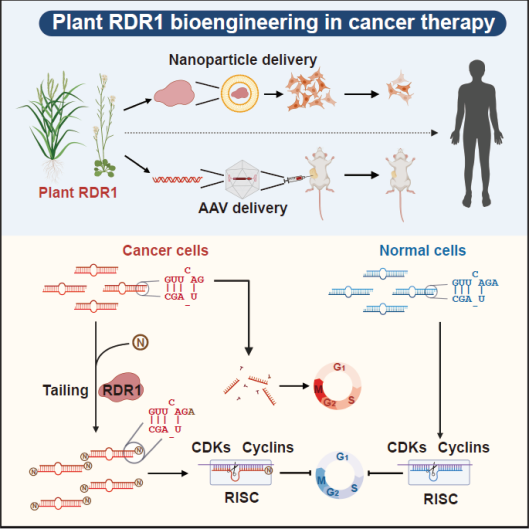
與miRNA不同,siRNA來源于不同RNA依賴性RNA聚合酶 (RDR) 合成的雙鏈RNA底物。有趣的是,RDR幾乎在所有真核生物中都已被發(fā)現(xiàn),但在進(jìn)化過程中,其在具有次級(jí)免疫系統(tǒng)的脊椎動(dòng)物中丟失。在植物中,依賴RDR1的siRNA尤其參與抗病毒免疫反應(yīng),是植物特有的、最核心的分子免疫反應(yīng)通路之一。近年來,跨物種生物工程已成功應(yīng)用于基礎(chǔ)研究和轉(zhuǎn)化醫(yī)學(xué),例如來自細(xì)菌的Crispr-Cas。因此,我們嘗試從動(dòng)植物免疫系統(tǒng)的差異出發(fā),在哺乳動(dòng)物中進(jìn)行基于植物RDR1的植物基因工程,并研究其相關(guān)的轉(zhuǎn)化醫(yī)學(xué)的應(yīng)用。
2022年5月26日,北京大學(xué)杜鵬課題組在Cell雜志在線發(fā)表了題為“A plant immune protein enables broad antitumor response by rescuing microRNA deficiency” 的研究論文。該研究發(fā)現(xiàn):
在不同的人類原發(fā)性癌癥樣本和癌癥細(xì)胞系中,不能有效結(jié)合AGO2復(fù)合體的3’末端短1-nt的miRNA異構(gòu)體廣泛積累。異位表達(dá)的植物免疫蛋白R(shí)DR1通過其單核苷酸加尾修飾這些AGO2游離出的miRNA雙鏈異構(gòu)體,以重新激活有缺陷的miRNA通路,從而特異性阻斷實(shí)體瘤和白血病中癌細(xì)胞的細(xì)胞周期。

二、振奮人心的研究結(jié)果
在本研究工作中,作者主要有以下4個(gè)發(fā)現(xiàn):
RDR1蛋白通過靶向細(xì)胞周期廣泛抑制癌細(xì)胞的增殖
為了在哺乳動(dòng)物細(xì)胞中進(jìn)行基于植物RDR1的生物工程,作者分別從擬南芥(At)和水稻(Os)中克隆RDR1基因到基于Dox誘導(dǎo)的慢病毒載體上。最終,本研究獲得了13個(gè)穩(wěn)定的RDR1誘導(dǎo)細(xì)胞系(包括7個(gè)實(shí)體瘤、3個(gè)白血病、3個(gè)非癌癥細(xì)胞系)和2個(gè)RDR1恒定表達(dá)的胚胎干細(xì)胞系。通過Western blot和活細(xì)胞成像,作者驗(yàn)證了RDR1在哺乳動(dòng)物細(xì)胞中成功實(shí)現(xiàn)了異位表達(dá)。
在接下來的研究中,令作者驚訝和意外的是,AtRDR1和OsRDR1能夠在體外顯著抑制所有10種癌癥細(xì)胞系的增殖,但對(duì)其他5種非癌細(xì)胞沒有影響。RDR1還可以顯著抑制癌細(xì)胞的克隆形成能力。在分子水平上,基于RNA-seq的基因集富集分析(GSEA)表明,AtRDR1和OsRDR1可以干擾所有癌癥細(xì)胞系中的細(xì)胞周期過程,但在非癌對(duì)照細(xì)胞中沒有明顯作用。
值得注意的是,短時(shí)間(2-3天)誘導(dǎo)RDR1同樣可顯著抑制癌細(xì)胞中的細(xì)胞周期過程,表明細(xì)胞周期通路可能是RDR1的直接作用靶點(diǎn)。隨后,EdU/PI染色分析顯示,RDR1在癌細(xì)胞中的表達(dá)顯著降低了S期的細(xì)胞比例,反而增加了G0/G1期的細(xì)胞比例。因此,作者認(rèn)為植物免疫蛋白R(shí)DR1是一種外源腫瘤抑制因子,它能夠特異靶向并干擾癌細(xì)胞中的細(xì)胞周期過程,但在非癌癥細(xì)胞中卻不起作用。
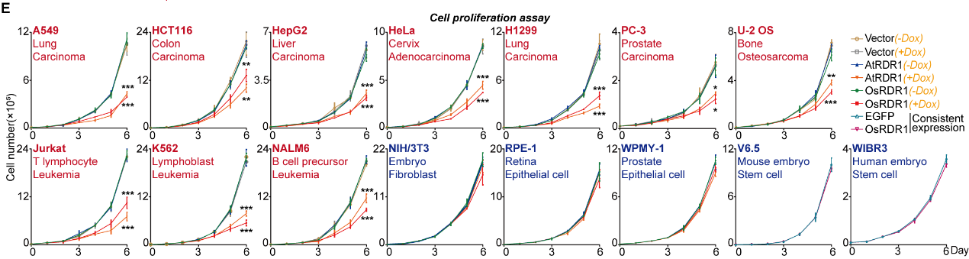
AtRDR1和OsRDR1廣譜且特異的抑制癌細(xì)胞增殖,但不影響非癌細(xì)胞系
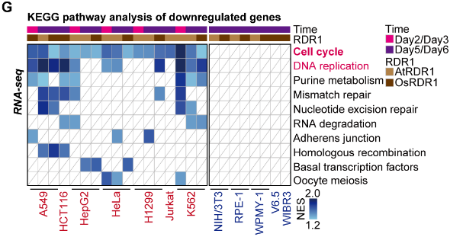
RDR1能夠特異靶向并干擾癌細(xì)胞的細(xì)胞周期,但對(duì)非癌細(xì)胞不起作用
3’末端短1-nt的miRNA異構(gòu)體在多種腫瘤中廣泛積累
由于RDR1參與植物中的小RNA通路,作者在RDR1誘導(dǎo)表達(dá)前后的癌癥和非癌癥細(xì)胞中進(jìn)行小RNA測(cè)序。令人驚訝的是,作者發(fā)現(xiàn)誘導(dǎo)RDR1后的癌癥細(xì)胞中miRNA的整體表達(dá)明顯增加,但在非癌癥細(xì)胞系中卻沒有出現(xiàn)這種現(xiàn)象。隨后,作者還通過miRNA通路關(guān)鍵組分的敲低和AGO2-CLIP等實(shí)驗(yàn),提出植物RDR1通過提高全局miRNA表達(dá)以特異挽救癌細(xì)胞中的miRNA缺乏來抑制細(xì)胞周期和增殖。
為了進(jìn)一步研究RDR1特異靶向癌細(xì)胞的機(jī)制,作者對(duì)已公開發(fā)表的小RNA測(cè)序數(shù)據(jù)進(jìn)行系統(tǒng)分析,包括TCGA數(shù)據(jù)庫的9980組癌癥病人數(shù)據(jù)以及GEO數(shù)據(jù)庫的癌癥病人、癌癥細(xì)胞系以及正常組織的數(shù)據(jù)。結(jié)果表明,在很多癌癥病人和細(xì)胞系的樣本中,在3’末端短1-nt的miRNA異構(gòu)體出現(xiàn)了大量的積累(圖3)。這些3’末端短1-nt的miRNA在部分癌癥樣本中甚至成為不同miRNA異構(gòu)體中數(shù)量最多的群體(圖3)。由于AGO蛋白結(jié)構(gòu)的特殊性,2-nt懸垂的結(jié)構(gòu)有利于miRNA雙鏈進(jìn)入AGO2中形成RISC[6]。作者提出,這種1-nt懸垂的異構(gòu)體,相比于2-nt懸垂的異構(gòu)體進(jìn)入AGO2的效率更低,并通過EMSA和MST實(shí)驗(yàn)進(jìn)行了驗(yàn)證。同時(shí),通過AGO2-IP的小RNA測(cè)序,作者進(jìn)一步分析發(fā)現(xiàn)3’末端短1-nt的miRNA異構(gòu)體在Input組更富集,進(jìn)一步表現(xiàn)出短1-nt的miRNA異構(gòu)體進(jìn)入AGO2的效率更低。綜上,作者提出,在癌細(xì)胞中,這種短1-nt的異常miRNA雙鏈異構(gòu)體不能有效地進(jìn)入到AGO2中,并且不穩(wěn)定,因此可能與不同腫瘤中的miRNA劑量減少有關(guān)。
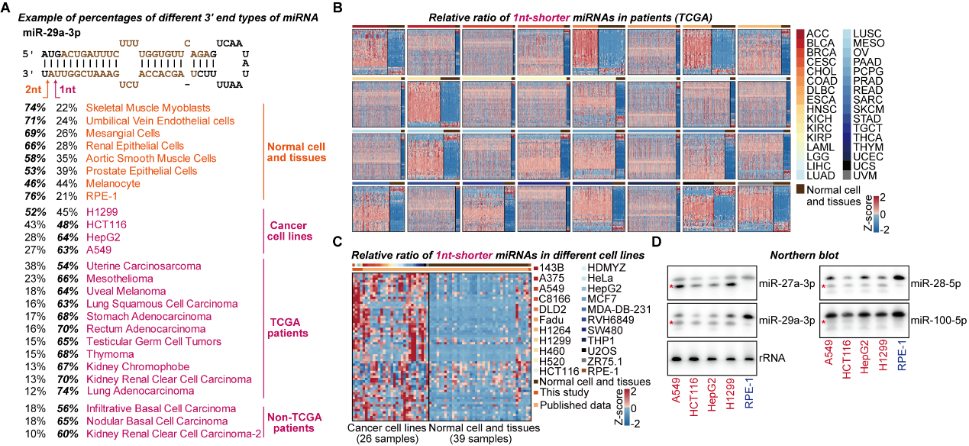
異常的3’末端短1-nt的miRNA異構(gòu)體在不同的人類腫瘤中廣泛積累
RDR1通過單核苷酸加尾修復(fù)癌癥中的miRNA異構(gòu)體
據(jù)報(bào)道,植物RDR6同時(shí)具有RNA聚合酶和核苷酸轉(zhuǎn)移酶活性[7],而在后續(xù)的小RNA測(cè)序數(shù)據(jù)分析中,作者發(fā)現(xiàn)具有3’端單核苷酸加尾的成熟miRNA特異富集于RDR1異位表達(dá)的癌癥細(xì)胞中。有趣的是,這種單核苷酸加尾主要出現(xiàn)在3’末端短1-nt的miRNA上,但很少出現(xiàn)在注釋的切割末端上。隨后作者在大腸桿菌中純化出重組的rAtRDR1和酶活位點(diǎn)突變的3DA mutant rAtRDR1。通過體外生化實(shí)驗(yàn),作者直接證明了rAtRDR1能夠?qū)捂渕iRNA和具有1-nt或2-nt懸垂的miRNA雙鏈進(jìn)行3’末端單核苷酸修飾,但不能修飾具有平末端的miRNA雙鏈。
結(jié)合以上的發(fā)現(xiàn),作者設(shè)想RDR1傾向于識(shí)別AGO2中游離出來的具有1-nt懸垂的miRNA雙鏈作為底物,這些異構(gòu)體尤其在癌癥細(xì)胞中積累,但在非癌癥細(xì)胞中不積累,并用單核苷酸加尾修飾這些有問題的miRNA。為了驗(yàn)證這一點(diǎn),作者首先在表達(dá)RDR1的肺癌A549細(xì)胞中進(jìn)行了AGO2敲低實(shí)驗(yàn),隨后進(jìn)行小RNA序列分析。正如預(yù)期的那樣,AGO2缺失確實(shí)進(jìn)一步加強(qiáng)了RDR1介導(dǎo)的miRNA修飾,在癌細(xì)胞中短1-nt的miRNA異構(gòu)體上單核苷酸加尾的比例大幅提高。之后,體外將rAGO2與具有1-nt/2-nt懸垂的miRNA雙鏈預(yù)孵育后再加入rRDR1進(jìn)行游離miRNA雙鏈的加尾實(shí)驗(yàn),結(jié)果顯示與AGO2親和力較低的1-nt懸垂的miRNA雙鏈在與rAGO2蛋白預(yù)孵育后更傾向于被RDR1修飾。
最后,作者還通過給1-nt懸垂的miRNA雙鏈加尾后的重新結(jié)合,1-nt/2-nt外源miR-34c雙鏈的體外轉(zhuǎn)染等實(shí)驗(yàn)和分析,共同證明了RDR1擁有核苷酸轉(zhuǎn)移酶活性,能夠?qū)GO2中游離出的短1-nt的miRNA雙鏈異構(gòu)體進(jìn)行單核苷酸修飾,以恢復(fù)這些異構(gòu)體對(duì)AGO2的裝載效率,并最終修復(fù)癌癥中有缺陷的miRNA通路。

AGO2缺失可顯著增強(qiáng)癌細(xì)胞中RDR1介導(dǎo)的miRNA加尾事件
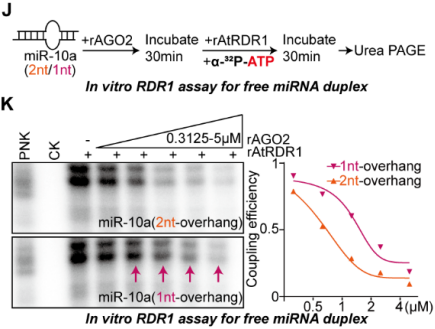
RDR1更傾向于識(shí)別游離的具有1-nt懸垂的miRNA雙鏈異構(gòu)體作為底物
RDR1抑制多種小鼠實(shí)體瘤和白血病的進(jìn)展
接下來,作者想在小鼠體內(nèi)驗(yàn)證植物RDR1的抗腫瘤作用。首先,作者將RDR1誘導(dǎo)型癌癥細(xì)胞系注射免疫缺陷小鼠以進(jìn)行體內(nèi)荷瘤實(shí)驗(yàn),并且通過Dox喂水以實(shí)現(xiàn)RDR1的異位表達(dá)。結(jié)果表明,野生型而非突變型RDR1顯著抑制了所成腫瘤的大小、體積和重量。作者還發(fā)現(xiàn),在A549,H1299和PC-3細(xì)胞所成的荷瘤中,植物RDR1能夠顯著提高癌細(xì)胞中miRNA的表達(dá),從而抑制了癌細(xì)胞的細(xì)胞周期。
類似的,作者還評(píng)估了RDR1在體內(nèi)白血病小鼠模型中的抗腫瘤作用。與載體對(duì)照或突變的RDR1相比,野生型RDR1能夠顯著抑制三種白血病細(xì)胞系(Jurkat、K562和NALM6)在免疫缺陷小鼠外周血中的增殖,并最終延長(zhǎng)異種移植小鼠的壽命。同樣,RDR1可以在體內(nèi)顯著增加白血病細(xì)胞中的miRNA表達(dá)以抑制白血病細(xì)胞中的關(guān)鍵細(xì)胞周期組分,包括CDK1、CCNE2、PLK1、CDK6等,從而抑制細(xì)胞周期。
最后,通過納米囊泡包裝體外純化的RDR1蛋白和AAV包裝的RDR1,分別在體外細(xì)胞和體內(nèi)實(shí)體瘤水平上實(shí)現(xiàn)了RDR1的直接遞送和腫瘤抑制。
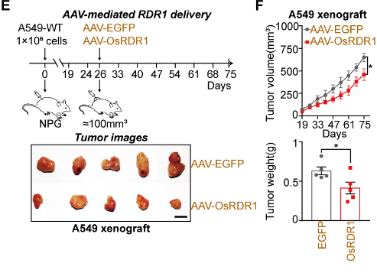
AAV遞送的RDR1抑制小鼠體內(nèi)實(shí)體瘤生長(zhǎng)
三、抗擊癌癥的強(qiáng)大武器
此項(xiàng)研究首次揭示了在各種人類原發(fā)性腫瘤中廣泛積累異常的3’末端短1-nt的miRNA異構(gòu)體,這為理解腫瘤發(fā)生過程中全局miRNA劑量的減少提供了新的見解。利用植物免疫蛋白R(shí)DR1,我們通過挽救癌細(xì)胞中的miRNA缺陷來實(shí)現(xiàn)廣譜的抗腫瘤反應(yīng),并開發(fā)了一種新的策略來編輯和操縱miRNA,使之成為對(duì)抗癌癥等人類疾病的強(qiáng)大武器。
北京大學(xué)生命科學(xué)學(xué)院/北大-清華生命科學(xué)聯(lián)合中心的杜鵬研究員為該論文的通訊作者。北京大學(xué)前沿交叉學(xué)科研究院博士研究生齊燁和生命科學(xué)學(xué)院博士研究生丁力為本文的并列第一作者。北京大學(xué)前沿交叉學(xué)科研究院博士研究生張司文參與了部分工作,北京大學(xué)博士姚升澤和博士后翁健莉也對(duì)本文有重要貢獻(xiàn)。北京大學(xué)李毅和吳虹教授合作參與完成了這一工作,并給予了大力支持。該項(xiàng)目得到了國(guó)家自然科學(xué)基金、北京大學(xué)“細(xì)胞增殖與分化”教育部重點(diǎn)實(shí)驗(yàn)室、北大-清華生命科學(xué)聯(lián)合中心和北大-啟東創(chuàng)新基金的資助。


